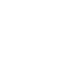Los materiales con cambio de fase (MCF) están más cerca de lo que pensamos, ¡y son muy comunes en nuestra vida diaria! Éstos incluyen desde la cera de una vela que se derrite con el calor de una llama, las gotas de rocío que se evaporan al recibir la energía del Sol, hasta el hielo que se derrite dentro de una bebida en una tarde calurosa. Estos ejemplos clásicos ilustran cómo ciertos materiales pueden cambiar su estado físico en respuesta a condiciones ambientales específicas. A continuación, se describen de manera general estos materiales. La materia existe en tres estados físicos fundamentales[1]: sólido, líquido y gaseoso (ver Figura 1). En el estado sólido, las partículas están fuertemente unidas en una estructura ordenada y apenas pueden moverse, manteniendo su forma y volumen definidos. Por otro lado, en el estado líquido, las partículas tienen más libertad de movimiento y pueden deslizarse unas sobre otras, lo que les permite cambiar de forma, pero mantener un volumen constante. En el estado gaseoso, las partículas tienen una energía cinética considerable, moviéndose libremente y ocupando todo el espacio disponible, sin forma ni volumen definidos. Estos estados de la materia son influenciados por factores como la temperatura y la presión, lo que puede causar transiciones entre ellos, como la fusión, la evaporación o la sublimación. Los procesos de cambio de fase implican la transferencia de calor entre un material y su entorno, lo que resulta en la transición de una fase a otra. Durante este proceso, el material puede ganar energía (por ejemplo, en fusión o evaporación) o cederla (en la condensación o solidificación), dependiendo del proceso. Cuando un material cambia y absorbe calor de su entorno, éste le permite romper las fuerzas de cohesión entre sus partículas. Por el contrario, el material cede energía a su entorno a medida que las partículas pierden energía y se reorganizan en una estructura más ordenada. Este intercambio de calor es esencial para entender cómo los materiales experimentan cambios de fase y cómo estos procesos afectan su comportamiento y propiedades.
Los MCF han desempeñado un papel fundamental a lo largo de la historia de la humanidad, revolucionando numerosos aspectos de nuestra vida cotidiana y contribuyendo significativamente al avance de la tecnología y la ciencia. Desde tiempos antiguos, la capacidad de manipular y utilizar materiales que experimentan cambios de fase ha sido crucial para el desarrollo de la metalurgia, la cerámica y la construcción. La invención y perfeccionamiento de técnicas como la fundición de metales y la fabricación de vidrio (como en la isla de Murano, Italia, ver Figura 2) han permitido la creación de obras de arte, herramientas, armas, recipientes y estructuras que han transformado la forma en que vivimos y trabajamos. En la actualidad, los MCF continúan desempeñando un papel vital en una variedad de campos y en nuestra vida diaria. El agua es uno de los ejemplos más comunes de MCF. La capacidad del agua para cambiar de fase en función de la temperatura y la presión es fundamental para una variedad de aplicaciones, que van desde enfriar bebidas y la cocción de alimentos hasta la generación de vapor en plantas de energía. La parafina es un tipo de cera que se utiliza en velas y representó una fuente principal de iluminación durante gran parte de la historia humana, desde la antigüedad hasta el siglo XIX. En la actualidad siguen siendo utilizadas por razones decorativas, ceremoniales y de emergencia. En el área de energía, los MCF permiten mejorar el confort térmico en las viviendas de una manera pasiva, lo que reduce los requerimientos energéticos de sistemas de calefacción o refrigeración. De hecho, las reservas limitadas de combustibles fósiles, el aumento de las emisiones de gases de efecto invernadero y el rápido crecimiento del consumo energético han resaltado la importancia de utilizar eficazmente la energía, y como hemos visto los MCF pueden tener un impacto positivo en esta área.

El uso de material de cambio de fase para el almacenamiento de energía térmica ofrece una solución adecuada, barata y eficaz para mejorar el rendimiento de los sistemas energéticos y, por tanto, reducir los picos de demanda y el consumo de energía. El almacenamiento de energía térmica incluye el almacenamiento de calor latente y el almacenamiento de calor termoquímico. Los sistemas de almacenamiento de calor latente son de bajo costo y más fáciles de trabajar que los termoquímicos. El uso MCF, también denominado material de almacenamiento de calor latente, es un método eficiente para almacenar energía térmica. En las últimas décadas, la investigación se ha enfocado en el cambio de fase en el que el almacenamiento de calor se lleva a cabo debido al calor latente de fusión, ya que los procesos de fusión/solidificación no implican cambios considerables en los volúmenes, que son un reto en el diseño de los contenedores. Existen varios tipos de MCF, pero se pueden clasifican en tres grupos: orgánicos (parafínicos y no parafínicos), inorgánicos (hidratos de sales y aleaciones metálicas) y eutécticos (mezcla de dos o más MCF: orgánicos, inorgánicos y ambos). En la Figura 3(a) se muestra una imagen del proceso de cristalización de galio, elemento que estudio en el IIM Unidad Morelia. La naturaleza de cada MCF determinará aspectos importantes para la selección de material más adecuado: i) su temperatura de cambio de fase, ii) conductividad térmica, y iii) estabilidad química. El primer punto define la aplicación, es decir, un MCF con una temperatura de fusión cercana a los 25 ºC se puede utilizar para el acondicionamiento térmico de viviendas, pero no para el control de temperatura de dispositivos electrónicos. La conductividad térmica determina la rapidez con la que los MCF transfieren energía. Un diseño deficiente puede hacer que funcionen como aislantes térmicos, resultando en la degradación del material. Finalmente, los MCF no deben sufrir degradación bajo operación durante un número dado de ciclos. Cada uno de los grupos antes mencionado tienen ventajas y desventajas.
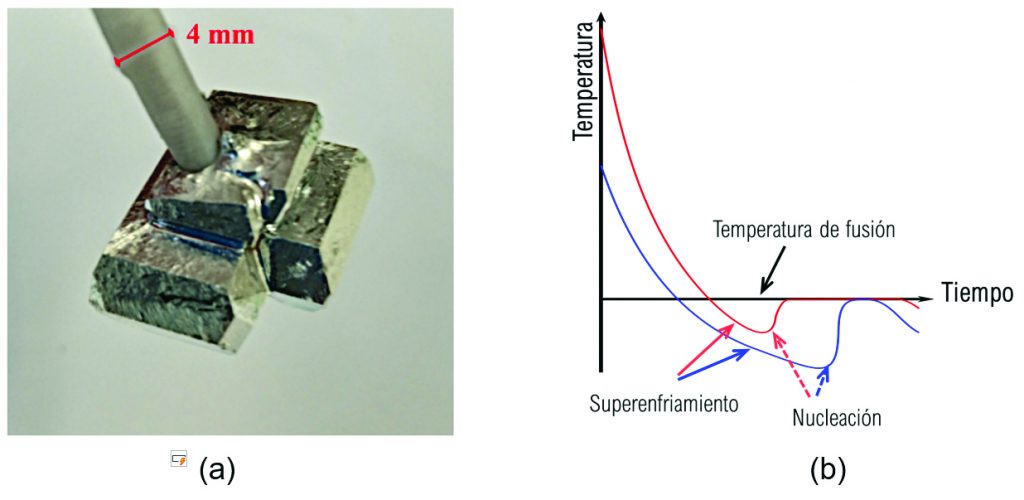
El superenfriamiento es un fenómeno que ocurre cuando un material se enfría por debajo de su punto de congelación sin cambiar de fase (solidificarse), como se observa en la Figura 3(b). En otras palabras, el material permanece en estado líquido a temperaturas por debajo de su punto de fusión. Este fenómeno está asociado con la falta de nucleación, es decir, la formación de los primeros cristales sólidos que desencadenan la solidificación. Se ha reportado que el grado de superenfriamiento depende del proceso de enfriamiento, de la interfase líquido-sólido (contenedor), de la pureza del material, entre otros. En particular, para sustancias puras como el galio se ha reportado superenfriamiento hasta -28 ºC, aunque su punto de fusión son 29.76 ºC (es decir ¡58 ºC por debajo de la temperatura de fusión!). El estudio del superenfriamiento es crucial en una variedad de campos debido a su impacto en la calidad y el comportamiento de los materiales.
En conclusión, los materiales con cambio de fase representan una fascinante área de estudio que abarca una amplia gama de sustancias y fenómenos. Su capacidad para absorber, almacenar y liberar energía térmica de manera eficiente los convierte en herramientas valiosas en numerosas aplicaciones, desde la regulación de la temperatura en edificios hasta la conservación de alimentos y la criopreservación de células. A medida que continuamos explorando y comprendiendo mejor las propiedades y comportamientos de estos materiales, seguiremos descubriendo nuevas formas innovadoras de utilizarlos en tecnología, medicina, industria y más, contribuyendo así al avance de la ciencia y la mejora de la calidad de vida en todo el mundo.
[1] Aunque también existen otros estados de la materia como el plasma, los superfluidos, el condensado de Bose-Einstein, entre otros, por el momento no nos enfocaremos en estos estados.
Etiquetas: 2024, BUM 107, IIM-UM, Cambio de fase, Materiales